Na história da medicina, poucos medicamentos foram desenvolvidos a partir de um conhecimento exato do alvo molecular a ser atingido. Foi assim com o imatinib.
Essa história começou no final dos anos ’50, quando o pesquisador Peter Nowell e o seu estudante de graduação David Hungerford estudavam leucemias e linfomas. Nas palavras de Nowell (2007):
Eu não sabia nada de citogenética nessa época mas achava que as preparações cromossômicas das células leucêmicas deveriam ser investigadas em busca de anormalidades… Eu e Hungerford, bem como outros pesquisadores ao redor do mundo, começamos a usar as novas técnicas citogenéticas para determinar se as leucemias humanas poderiam ser caracterizadas por anormalidades cromossômicas específicas.
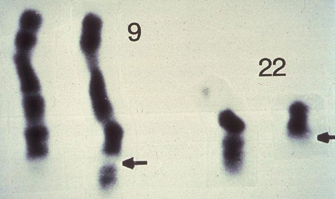
Nowell e Hungerford começaram a sua busca pesquisando células de pacientes com leucemia mieloide aguda (LMA). Eles não encontraram anormalidades cromossômicas consistentes nesses pacientes. Essa tendência continuou até que a dupla de cientistas começou a trabalhar com pacientes com leucemia mieloide crônica (LMC). Hungerford notou um pequeno cromossomo atípico nas células malignas de dois pacientes com essa leucemia. Expandindo a pesquisa, eles encontraram esse mesmo cromossomo anormal em outros cinco pacientes com LMC. Esse cromossomo foi logo denominado “cromossomo Filadélfia”, em homenagem à cidade onde ele foi descoberto.
Estudos posteriores indicaram que o cromossomo Filadélfia é uma variante do cromossomo 22 que perdeu o seu braço longo e tem no lugar o braço longo do cromossomo 9. A transferência entre os braços longos dos cromossomos 9 e 22 é chamada de translocação recíproca.
Em 1983, pesquisadores do National Cancer Institute e da Erasmus University demonstraram que o oncogene humano c-abl é localizado na região do cromossomo 9 que se transloca para se tornar parte do cromossomo Filadélfia (Heisterkamp et al., 1983). Em 1984, a mesma equipe de pesquisadores identificou o que eles chamaram de “região aglomerada de quebra” (breakpoint cluster region) ou bcr, ou a região de 5,8-kilobase na qual todos os pontos de quebra do cromossomo 22 parecem ocorrer nos pacientes de LMC com o cromossomo Filadélfia (Groffen et al., 1984). Os pesquisadores concluíram que esses dois genes, denominados conjuntamente como a fusão bcr-abl, eram a provável causa molecular da LMC.
Em 1990, pesquisadores da Universidade da Califórnia em Los Angeles identificaram a função do gene da fusão bcr–abl : produção de uma proteína tirosina quinase anormal que não é adequadamente regulada (Lugo et al., 1990). A tirosina quinase é uma molécula sinalizadora comum que, quando ativada, induz a divisão celular. Nos pacientes com LMC, a tirosina quinase mutante fica ativa por muito tempo, fazendo as células se dividirem a um ritmo anormalmente elevado. Essa proliferação resulta em superpŕodução e acúmulo de células brancas imaturas do sangue, que é o que caracteriza a LMC.
Com base nesse conhecimento, o oncologista Brian Druker, pesquisador da Oregon Health and Science University, começou a busca por compostos que bloqueassem seletivamente essa tirosina quinase anormal. As buscas foram auxiliadas por simulações moleculares em computador e testes em culturas de células. Em parceria com a farmacêutica Ciba-Geigy, ele obteve um composto que reduzia em 92 a 98% o número de colônias celulares bcr-abl em culturas, sugerindo eficácia, ao mesmo tempo em não causava decréscimo na formação de colônias celulares normais, apontando para provável segurança (Druker et al., 1996).
Dois anos depois, esse composto, denominado ST1571 e posteriormente chamado de imatinib, foi testado no primeiro ensaio clínico: uma pequena fase I com apenas 31 pacientes. Notavelmente, todos os 31 pacientes entraram em remissão, com normalização do hemograma. Em alguns desses pacientes, houve também remissão citogenética, com o desaparecimento do cromossomo Filadélfia das suas células sanguineas.
Mais recentemente, os resultados de um estudo com 5 anos de follow-up foram igualmente notáveis. Nesse estudo, Druker e colaboradores relataram que, após 60 meses de terapia com imatinib, 98% dos pacientes apresentaram uma resposta hematológica completa. Também com 60 meses, o índice de sobrevida para os pacientes era de 89%, com um índice de recidivas de apenas 17% (Druker et al., 2006).
O caso do imatinib é excepcional, e é improvável que o mesmo sucesso seja alcançado com outros tipos de câncer. Ao contrário da maioria das neoplasias malignas, que são causadas por uma interação complexa de fatores genéticos e ambientais e portanto têm muitos alvos terapêuticos potenciais, a LMC é causada por uma única proteína aberrante relacionada a uma translocação cromossômica consistente. Sendo assim, os cientistas puderam concentrar os seus esforços nesse alvo molecular único. Não obstante, a história do imatinib é um belo exemplo de como o conhecimento da biologia celular pode levar a um tratamento médico que salva vidas.
Referências
Druker, B. J., et al. Effects of a selective inhibitor of the Abl tyrosine kinase on the growth of Bcr-Abl positive cells. Nature Medicine 2, 561–566 (1996) doi:10.1038/nm0596-561 (link to article)
Druker, B. J., et al. Efficacy and safety of a specific inhibitor of the BCR-ABL tyrosine kinase in chronic myeloid leukemia. New England Journal of Medicine 344, 1031–1037 (2001)
Druker, B. J., et al. Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia. New England Journal of Medicine 355, 2408–2417 (2006)
Groffen, J., et al. Philadelphia chromosomal breakpoints are clustered within a limited region, bcr, on chromosome 22. Cell 36, 93–99 (1984)
Heisterkamp, N. et al. Localization of the c-abl oncogene adjacent to a translocation break point in chronic myelocytic leukaemia. Nature 306, 239–242 (1983) doi:10.1038/306239a0 (link to article)
Lugo, T. G., et al. Tyrosine kinase activity and transformation potency of bcr-abl oncogene products. Science 247, 1079–1082 (1990) doi:10.1126/science.2408149
Nowell, P. C. Discovery of the Philadelphia chromosome: A personal perspective. Journal of Clinical Investigation 117, 2033–2035 (2007)
0 comentário